Die Verfahren der Keimzahlbestimmung und der D-Wert-Ermittlung sind gängige Praxis zur Charakterisierung und Qualitätsprüfung von BIs.
Sterilisationsprozesse, die der aseptischen Abfüllung von Arzneimitteln vorausgehen oder sie begleiten, müssen nachweislich funktionieren (EU GMP, Vol. 4, Annex 1).
Um die Wirksamkeit von Dekontaminations- und Sterilisationsprozessen zu bestätigen, werden Sporen spezieller Bakterien als biologische Indikatoren (BIs) eingesetzt. Sowohl für Sterilisationsprozesse in Autoklaven als auch für Dekontaminationsprozesse mit gasförmigem Wasserstoffperoxid (H2O2) in Isolatoren nimmt man gewöhnlich die Sporen von Geobacillus stearothermophilus.
Diese Sporen sind als Modellsystem sehr gut geeignet, da sie besonders widerstandsfähig sind. Die Kultivierung von Geobacillus stearothermophilus erfolgt bei relativ hohen Temperaturen (55–60°C), wodurch die Testauswertung spezifischer wird.
Bei den BIs für Dekontaminationsprozesse werden die Sporen, die in Form einer Monoschicht auf Edelstahlträger aufgebracht sind, zur besseren Handhabung in Tyvek®-Briefchen eingeschweißt. Obwohl diese Folie für H2O2 durchlässig ist, stellt sie für den mit Sporen beimpften Träger eine Diffusionsbarriere und somit ein Worst-Case-Szenario dar.
Nach dem Einsatz werden die Träger aus den Tyvek®-Briefchen in Nährmedien überführt und inkubiert. Zeigt sich nach sieben Tagen kein Wachstum, wurden durch den wirksamen Dekontaminationsprozess alle Sporen auf dem Träger abgetötet.
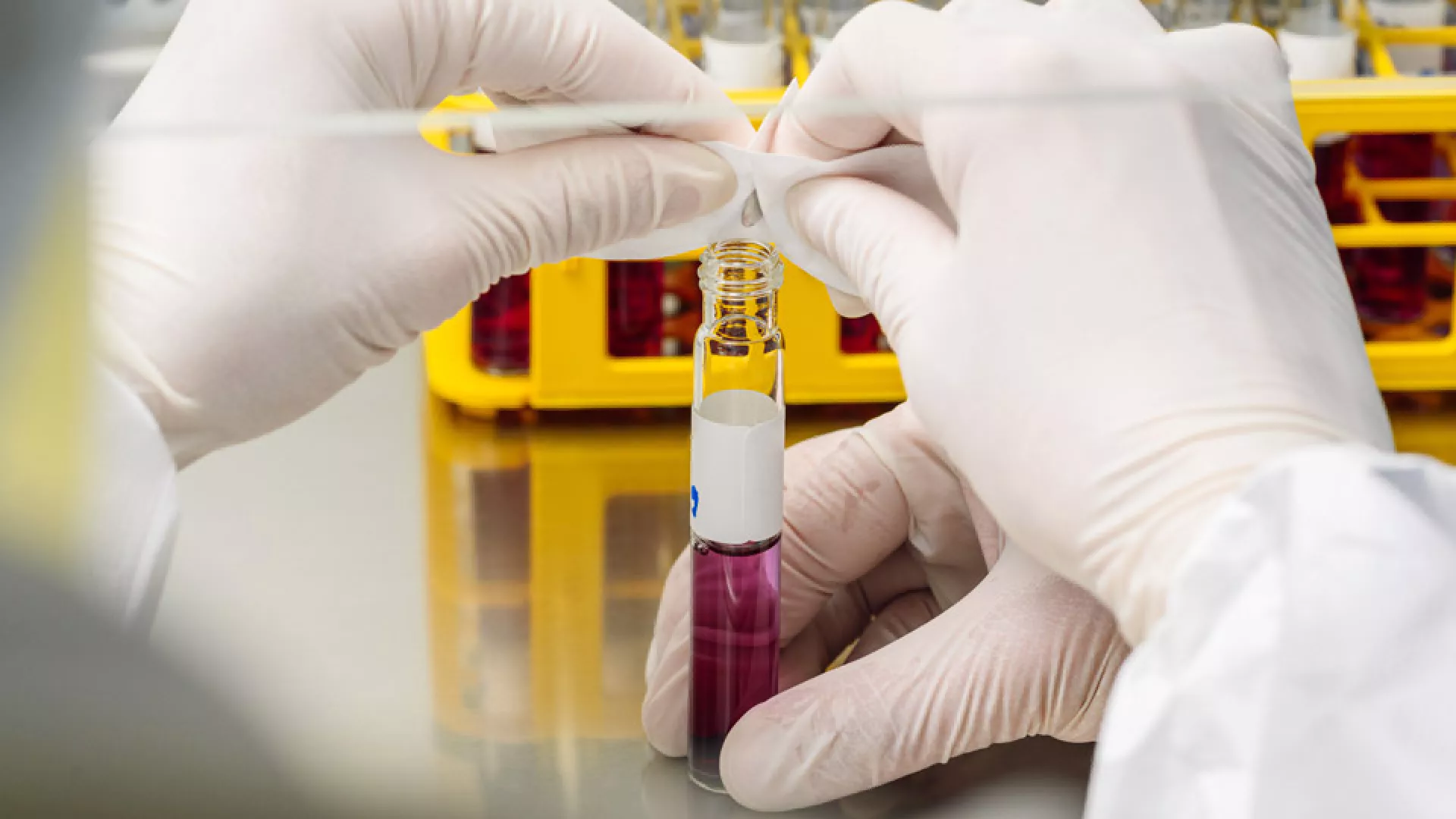
Überführung der Sporenträger in Nährmedium
Dekontaminationsprozesse sollen üblicherweise eine 6-log-Reduktion von Mikroorganismen erbringen. Um diesen Nachweis führen zu können, muss ein BI mit mindestens 106 Sporen belegt sein.
Darüber hinaus sollen die Sporen eine definierte Resistenz besitzen. Diese ist Schwankungen unterworfen, da die Sporen ein nicht-kalibrierbares biologisches System darstellen. Mit dem D-Wert (Dezimale Reduktionszeit) lässt sich ein Kennwert für die Resistenz einer spezifischen BI-Charge ermitteln. In ein und demselben System bestimmt, lassen sich über die D-Werte verschiedene Chargen hinsichtlich ihrer Resistenz vergleichen. Zudem ergeben sich dabei Erkenntnisse über das Abtötungsverhalten einer Charge und eventuell auftretende hyperresistente Indikatoren („rogue BIs“, „late survivors“ oder auch „anomalous BIs“). Eine Charge, die solche Indikatoren enthält, sollte nicht zu Validierungszwecken eingesetzt werden, da hierdurch falsch positive Ergebnisse entstehen können.
In der Norm DIN EN ISO 11138-7:2019-11 sind die Modalitäten festgelegt, die für die Bestimmung einer validen Keimzahl und eines validen D-Werts zur Charakterisierung und Qualitätsprüfung von BIs einzuhalten sind.
Unsere Experten für Isolatoren unterstützen Sie optional bei den folgenden Themen:
Keimzahlbestimmung
Die Keimzahlbestimmung erfolgt gemäß DIN EN ISO 11138-7:2019-11: Sterilisation von Produkten für die Gesundheitsfürsorge – Biologische Indikatoren – Teil 7: Leitfaden für die Auswahl, Verwendung und Interpretation von Ergebnissen (ISO 11138-7:2019); Deutsche Fassung EN ISO 11138-7:2019 aus vier Einzelproben nach der Hitzeschock-Methode.
Bestimmung des System-D-Wertes
Die Bestimmung des System-D-Werts erfolgt in Anlehnung an DIN EN ISO 11138-7:2019-11: Sterilisation von Produkten für die Gesundheitsfürsorge – Biologische Indikatoren – Teil 7: Leitfaden für die Auswahl, Verwendung und Interpretation von Ergebnissen (ISO 11138-7:2019); Deutsche Fassung EN ISO 11138-7:2019 aus 30 Probengruppen mit jeweils 10 oder 20 Einzelproben und einem Entnahmeintervall von einer Minute.
Der D-Wert wird nach dem Begrenzten Holcomb-Spearman-Karber-Verfahren (LHSKP) ermittelt.
Die Bestimmung des D-Wertes erfolgt in einem standardisierten System. Darüber hinaus kann ein Kunde aus vordefinierten Werten von H2O2-Konzentration und relativer Feuchte wählen, um eine D-Wert-Bestimmung möglichst nahe an seine Bedingungen anzupassen.
Keimidentifizierung mittels API 50
Die Keimidentifizierung erfolgt mittels eines API® 50 CHB/E-Tests von bioMérieux. Parallel wird der zu identifizierende Stamm als KWIK STIK™ mitgeführt.
Diese Eingangsqualifizierung und Qualitätsüberprüfung der BIs erfolgt im Testlabor der Valicare unter Einsatz eines Isolators im Pharmamaßstab.
Kontaktieren Sie uns bitte rechtzeitig, wenn wir Sie bei der Prozessentwicklung und -validierung Ihres Isolators unterstützen sollen und der Einsatz von BIs geplant ist. Wir führen eine vollständige Eingangsprüfung Ihrer BI-Charge durch und stellen Ihnen für den Entwicklungs- und Validierungsprozess ausreichend charakterisierte BIs zur Verfügung.
Nutzen Sie den Vorteil von BIs, die unter realen Bedingungen im Isolator getestet und charakterisiert wurden. Wenn auch Sie H2O2 zur Dekontamination in Ihrem Isolator einsetzen, erhalten Sie den D-Wert für Ihre BIs in ihrem Anwendungsbereich verlässlich ermittelt und eine Aussage zu Anomalien.
Das erspart viel Zeit bei der Entwicklung und Validierung des Biodekontaminationsprozesses.












